Elektrocardiogram (ECG) -signaal is een krachtige gegevensbron om de hartfunctie te bestuderen en verschillende abnormale aritmieën te diagnosticeren. In dit artikel ExpositMachine Learning Engineer Artem Khodakov en MedRecord Analyst en Medical Doctor Elena Rostovtseva delen hoe Machine Learning en deep learning-technieken kunnen helpen bij het meten van hartslagvariaties (HRV) en het detecteren van atriumfibrilleren (AF).
Belang van HRV-monitoring en AF-detectie voor hartpatiënten
Hartslagvariabiliteit
In de tweede helft van de 20e eeuw werd een significante invloed van het autonome zenuwstelsel op cardiovasculaire mortaliteit, inclusief plotselinge hartdood, erkend [10]. Met andere woorden, de hartslag is een indicator van afwijkingen in het autonome zenuwstelsel, en een verandering in de hartslagvariatie is de vroegste voorspeller van veel ziekten.
Het autonome zenuwstelsel is het belangrijkste mechanisme voor het regelen van de hartslag en ritme-regulatie, samen met andere mechanismen zoals pacemakerweefsels. De afhankelijkheid tussen een aanleg voor dodelijke aritmieën en tekenen van verhoogde sympathische activiteit of verminderde activiteit van de nervus vagus wordt aangetoond in experimenten. Dat had op zijn beurt invloed op de ontwikkeling van kwantitatieve markers van de activiteit van het autonome zenuwstelsel, waaronder een van de meest veelbelovende markers is de hartslagvariabiliteit (HRV).
De klinische relevantie van hartslagvariatie werd voor het eerst ontdekt in 1965 door Hon en Lee [11], zoals ze opmerkten, dat foetale nood (veranderingen in de hartslag) voorafging aan de veranderingen in het dynamische bereik van hartintervallen en ontdekten hoe om deze pathologische aandoening te voorkomen. Sindsdien zijn er verschillende onderzoeksprojecten op het gebied van HRV uitgevoerd (Sayers, Ewing, Wolf, Akselrod, enz.), En zijn er veel wetenschappelijke werken gewijd aan de studie van HRV.
Het klinische belang van HRV werd duidelijk aan het einde van de jaren tachtig, toen werd bewezen dat bepaalde HRV-parameters sterke en onafhankelijke voorspellers van mortaliteit na een acuut myocardinfarct zouden kunnen zijn. [12]. HRV kan aanvullende waardevolle informatie verschaffen over fysiologische en pathologische aandoeningen en de risicostratificatie verhogen. In de klinische praktijk wordt de analyse van HRV-gebruik steeds groter. De populariteit van deze techniek stijgt vanwege de hoge voorspellende betekenis van de resultaten met de relatieve eenvoud van de analyse.
Boezemfibrilleren
Boezemfibrilleren (AF) is een van de meest voorkomende aanhoudende hartritmestoornissen in de cardiologische praktijk. Het verhoogt het risico op overlijden, hartfalen, trombo-embolische complicaties (bijv. Beroerte, longembolie) en leidt vaak tot ziekenhuisopname van patiënten [9]. Samen met de vergrijzing van de wereldbevolking en hogere overlevingskansen van chronische ziekten, groeit de prevalentie van atriumfibrilleren (AF) exponentieel [13]. De daarmee samenhangende morbiditeit en mortaliteit maken AF dus tot een aanzienlijke belasting voor de volksgezondheid. Het volksgezondheidsaspect van AF inspireert de drang om risicofactoren voor AF te onderzoeken en de nauwkeurigheid van AF-voorspelling en -beheer te verbeteren. De huidige technologische (bijv. EHealth) en methodologische (kunstmatige intelligentie) vorderingen zijn relevant voor toekomstige ziektepreventie en ziektemanagement.
De schattingen van AF-prevalentie in de Verenigde Staten variëren van ongeveer 2,7 miljoen tot 6,1 miljoen en dat aantal zal naar verwachting stijgen tot 12,1 miljoen in 2030. Volgens een onderzoek uit 2013 bedroeg het geschatte aantal mensen met boezemfibrilleren in 2010 33,5 miljoen. Dat is ongeveer 0,5 procent van de wereldbevolking [2].
Machine Learning in AF-detectie en HRV-analyse
Theoretisch kader
Het meten van hartslagvariaties onthult een breed scala aan informatie over lichaam en gezondheid, zelfs als andere fysiologische parameters nog binnen hun normale of geaccepteerde bereik vallen. Het is wetenschappelijk bewezen dat HRV een van de beste maatregelen is om de ANS-functie (autonoom zenuwstelsel) te testen [1]. HRV-analyse omvat 2 verschillende benaderingen:
- Tijddomein methoden zijn gebaseerd op metingen van RR-intervallen. Tijdsdomein omvat een hele reeks statistieken, elk met een specifieke interpretatie van variabiliteit. Deze maatstaven werden gestandaardiseerd in een rapport van de Task Force van ESC / NASPE in 1996 [3].
- Frequentie domein analyse die de stroomverdeling in het frequentiedomein bestudeert. Het laat zien hoeveel van het signaal binnen een bepaalde frequentieband ligt. Hoge (HF) frequenties tussen 0,15 – 0,40 Hz zijn geassocieerd met parasympathische activiteit (herstel) en lagere frequenties (LF) tussen 0,04 – 0,15 Hz zijn gekoppeld aan zowel sympathische als parasympathische activiteit [4].
Gegevens en methoden
In deze studie wordt AF gedetecteerd met behulp van deep learning-technologieën. Convolutioneel neuraal netwerk (CNN) wordt ingezet voor ECG-classificatie op NO (normaal ritme) en AF. We gebruikten de gegevensset “AF-classificatie van een korte ECG-opname met enkele afleiding – De PhysioNet Computing in Cardiology Challenge 2017” (8528 ECG-monsters) om de prestaties van ons AF-detectiemodel [5, 6] te trainen en te evalueren.
Een van de uitdagingen die we tijdens dit onderzoek hebben opgelost, is het vinden van segmenten op een ECG (mogelijkheid om een signaal te annoteren). Door detectie van QRS-pieken, maar zowel P-golven als T-golven, kunnen we een gedetailleerd rapport over ECG genereren, inclusief lengtegraad- en amplitude-afwijkingen van segmenten. We kunnen ook HRV-statistieken analyseren door RR-intervallen te berekenen.
QT Database is gebruikt voor training van annotatie-algoritmen [7, 6]. QT omvat 105 ECG-opnames van vijftien minuten met twee afleidingen. We gebruiken Hidden Markov Model (HMM) voor ECG-annotatie, dat is getraind op QT Database.
Onderzoeksresultaten
Er zijn 2 uitvoerformaten voor elk Machine Learning-model:
- Pure data (in JSON, XML of binair formaat) die gebruikt kunnen worden in API-verzoeken voor verdere analyse of visualisatie.
- Gevisualiseerde gegevens verkregen met behulp van plotbibliotheken van Python.
Resultaten van ECG-segmentatie en HRV-meting bevatten een geannoteerd signaal met QRS-pieken in de tijd en een lijst met HRV-parameters. Afhankelijk van het uitvoerformaat kan het worden geleverd als een JSON-object of worden afgedrukt en opgeslagen als een geplot geannoteerd signaal (Figuur 1) en een tabel met parameters (Figuur 2).
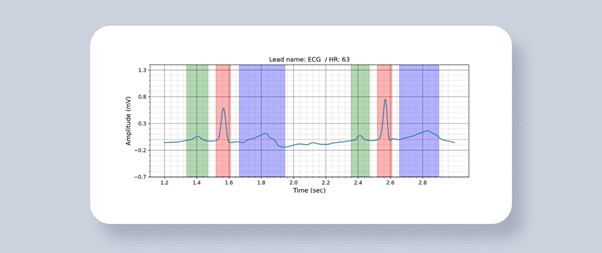
Figuur 1. ECG-segmentatie. Gekleurde gebieden zijn voorspellingen van golven en segmenten. Groen gebied – P-golf, rood gebied – QRS-segment, blauw gebied – T-golf.
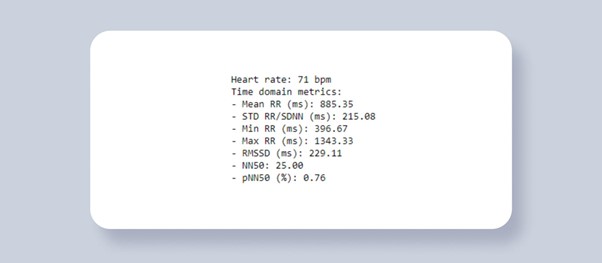
Figuur 2. HRV-analyse. Metrische gegevens over het tijdsdomein.
De resultaten van AF-modeltraining worden hieronder weergegeven. Het model is getraind om ingevoerde ECG-gegevens in twee klassen te classificeren: de ene met atriumfibrilleren (‘AF’ -label) en de andere die dat niet doet (‘NO’ -label).
U kunt de prestaties van het model zien in de onderstaande afbeelding (afbeelding 3). Het bovenste gedeelte van de tabel geeft u de trainingsstatistieken op klasniveau. Het omvat precisie(positief voorspellende waarde, PPV),recall (gevoeligheid), F1-score (een maat voor de nauwkeurigheid van een test) en ondersteuning(het aantal monsters). We testen ons model op een dataset die nog nooit in het trainingsproces is gebruikt om betrouwbare schattingen en objectieve evaluatie van de effectiviteit van het model te geven: F1 0.9-waarde betekent dat 90% van de AF-ECG’s correct is geclassificeerd.
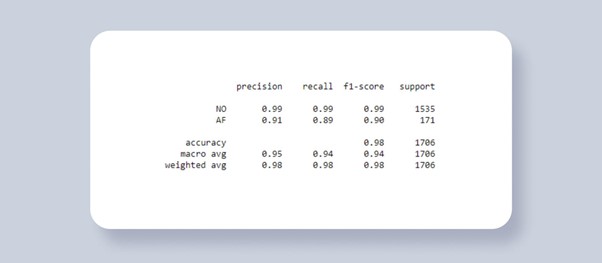
Figuur 3: Trainingsresultaat van het atriale fibrillatiemodel gegenereerd met behulp van scikit-learn classificatierapport.
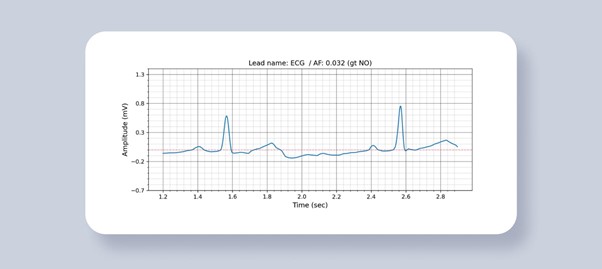
Figuur 4. AF-detectieresultaat. De waarschijnlijkheid van AF en grondwaarheidswaarde wordt in de titel geschreven.
MEDrecord-softwarevertegenwoordigt de ECG-opnames in overeenstemming met de HL7 FHIR-normen, waardoor de waarde van de klinische ECG-gegevens kan worden behouden.
Referenties
- “Over ECG en HRV”. MedTech
- Jen Thomas, Gerhard Whitworth, R.N. “Atrial Fibrillation: Facts, Statistics, and You” Healthline, 16 March 2020.
- Malik, Marek. (1996). Heart rate variability: Standards of measurement, physiological interpretation, and clinical use. Circulation. 93. 1043-1065.
- Salomon Tetelepta. “Exploring Heart Rate Variability using Python” Kaggle, 6 January 2019.
- “AF Classification from a Short Single Lead ECG Recording – The PhysioNet Computing in Cardiology Challenge 2017”. PhysioNet.
- Goldberger, A., et al. “PhysioBank, PhysioToolkit, and PhysioNet: Components of a new research resource for complex physiologic signals. Circulation [Online]. 101 (23), pp. e215–e220.” (2000).
- “QT Database”. PhysioNet.
- Laguna P, Mark RG, Goldberger AL, Moody GB. A Database for Evaluation of Algorithms for Measurement of QT and Other Waveform Intervals in the ECG. Computers in Cardiology 24:673-676 (1997).
- Patel NJ, Deshmukh A, Pant S, et.al. Contemporary trends of hospitalization for atrial fibrillation in the United States, 2000 through 2010: implications for healthcare planning. Circulation. 2014 Jun;129(23):2371-9.
- Corr PB, Yamada KA, Witkowski FX. Mechanisms control-ling cardiac autonomic function and their relation to arrhyth-mogenesis. In: Fozzard HA, Haber E, Jennings RB, Katz AN,Morgan HE, eds. The Heart and Cardiovascular System. NewYork: Raven Press, 1986: 1343–1403
- Hon EH, Lee ST. Electronic evaluations of the fetal heart rate patterns preceding fetal death, further observations. Am J Obstet Gynec 1965; 87: 814–26.
- Bui Min Ziep, Taratukhin E. Possibility of the Heart Rate Variability analysis. Russian Journal of Cardiology № 6/2011.
- Jelena Kornej, Christin S. Börschel, Emelia J. Benjamin, Renate B. Schnabel Epidemiology of Atrial Fibrillation in the 21ts Century. 2020